最近有两篇文章很火。因为大家又找到理由怼CRISPR-Cas9了。
就是下面这两篇:
 第一篇
第一篇
题目翻译过来是:CRISPR-Cas9基因编辑诱导P53引起的DNA损伤反应(注意,这里不是说引起P53损伤DNA,而是说P53对DNA损伤的反应,这种反应是一种保护措施。)
 第二篇
第二篇
题目翻译过来是:P53抑制(注意,即使在P53正常表达的细胞中也不是完全阻止)CRISPR-Cas9编辑人多功能干细胞
读完题目,首先小编想帮CRISPR-Cas9说两句话,希望大家不要错怪她!
请大家明确,这两篇文章的结果以及这两篇文章的所有单词都没说:
1.CRISPR-Cas9基因编辑致癌。
2.CRISPR-Cas9成功编辑的细胞是癌细胞或会变成癌细胞。
3.只有P53损坏的细胞才能被CRISPR-Cas9编辑。
4.CRISPR-Cas9破坏细胞的P53基因。
5.CRISPR-Cas9基因编辑本身可导致P53损伤或者有致癌倾向的细胞比例升高。
6.癌细胞中没有正常的P53或者P53不正常的都是癌细胞。
总结一下,就是这两篇文章都没说也不能说明CRISPR-Cas9用于人体会致癌。
那么这两篇文章实际上说了什么呢?
●其实这两篇文章的背景比较像。就是研究者们发现干细胞在未来基因编辑治疗上或者药物靶点筛选上可能会大有用处,但是悲剧的是干细胞的基因编辑效率太低了。这是一个需要探讨和解决的问题。
而这两篇文章的作者都非常开心地发现抑制P53可以提高干细胞的基因编辑效率。但是P53大家都知道是一个抑癌基因,不敢随便动的。所以如果要做治疗的话,得找到一个平衡点,一边提高编辑效率,一边不能把P53抑制太狠,导致突变大量产生出现癌症等恶果。
注意,两篇文章的讨论重点都在抑制P53可能会产生的后果。而CRISPR-Cas9是干嘛的来着?
——不仅不抑制,甚至还刺激P53高表达!!
另外,两篇文章的作者也提出了对CRISPR基因编辑的担忧。这个担忧不在于CRISPR-Cas9本身,而在于人类正常细胞中本来就有一些细胞是P53突变。这些细胞中P53的表达大概率都被抑制了。而这些细胞天生就会更容易被CRISPR-Cas9编辑。而P53的突变或许会使这些细胞更容易变成癌细胞(注意是或许。因为细胞的内控机制其实很复杂,也并不只有P53才能抑癌)。如果咱们经过筛选只留下经过编辑的细胞,或者编辑时间过长,P53有问题的细胞因为不受Cas9引起的生长抑制而比其他正常细胞长得更快,那么咱们最终获得的细胞就可能有更大的比例是P53有问题且可能更容易癌变的细胞。
所以,基于CRISPR-Cas9的基因编辑在临床应用上非常有前景。但是编辑时间要控制好,还要保持一个效率及安全性的平衡点。
另外,临床应用上,基因编辑后不对细胞进行编辑位点的阳性筛选或许会是个更安全的选择。
最后小编我想说的是:
可能因为原文太长,现在大家不看原文就道听途说脑洞大开的时候真的很多!就像这一次有人将这两篇文章的结论跟CRISPR-Cas9编辑致癌划等号一样。
可是,如果你不看原文,尤其是做科研做研发的你,如果不看原文就可能错过发Nature的机会!!
两篇文章的作者都为你的Natue文章指明了道路:
1.搞清楚CRISPR-Cas9引起DNA损伤反应的机理(比如,P53高表达的具体机制)
2.或者找到一个CRISPR-Cas9基因编辑效率与P53表达间的最佳平衡点。
3.P53和Cas9两个大热点的结合,真的容易发大文章!
所以:
什么?你不要买细胞?你只想当群众?
那么动手帮我们转发这篇文章吧~让其他需要的小伙伴看见吧!!
EdiGene正在开发基于基因组编辑技术的多种疗法,用于治疗目前传统疗法难以治愈的疾病。比如癌症,比如遗传病,比如难治复发的病毒性疾病。您的每一次转发和购买都是对我们努力的支持!
~好了~一波广告打完了~朋友别走
最后的最后,可能是一些小伙伴想看的,原文截图及翻译:
·文章一:
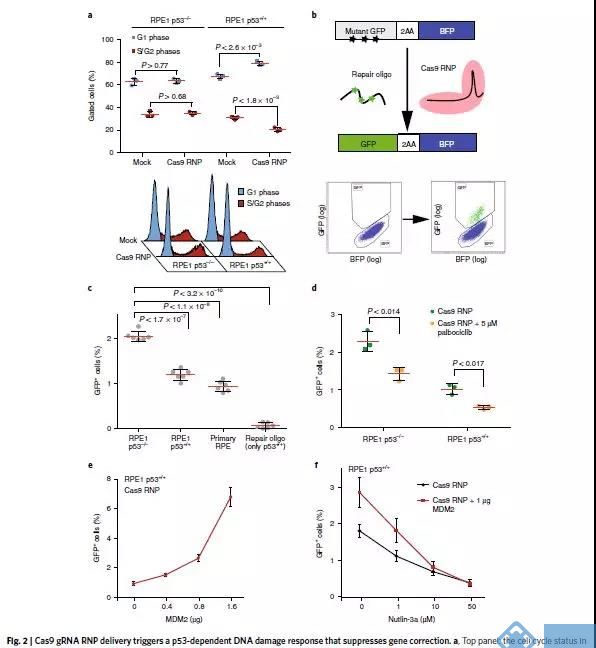
图一数据说明:CRISPR-Cas9产生的DSB可激活P53-p21-pRB这条线,引起细胞周期抑制,使细胞在被编辑的这段时间里长得更慢。所以如果P53出问题,在编辑的过程中,细胞生长就会相对更快。
图二数据说明:转Cas9和gRNA的 RNP进细胞进行基因编辑导致P53高表达,细胞周期被Hold在G1期,这期间由于基因组DNA不复制,所以会抑制细胞进行基于同源重组的基因编辑修复。但如果P53被抑制或者出问题,这种同源重组基因编辑修复的效率就可以提上去。
最后就是这篇文章的结论:
抑制DNA损伤信号可以在正常细胞中提高精准编辑的效率。然而,抑制P53可能会在一小段时间内使得细胞基因组容易出现重组及其它肿瘤相关突变。其实,在正常的细胞中短暂地抑制P53,对经基因编辑的细胞的成瘤性可能会有促进作用也可能会有抑制作用。一方面,那些本来基因组有损伤的基因可能会逃脱(P53的制裁),另一方面则在增加了编辑效率的同时降低了那些本来P53就有问题的细胞的生存优势(因为正常细胞P53也被抑制了,所以大家在基因编辑时生长速度都差不多,不会在基因编辑过程中,使P53有问题的细胞比例提高)。为找到一个平衡,未来大家可以集中精力,搞清楚Cas9引起的DNA损伤反应,从而通过控制DNA损伤信号,更高效地修正基因却不形成及富集潜在致瘤细胞。这对于开发更安全更高效的下一代基因编辑技术是非常重要的。
·文章二:
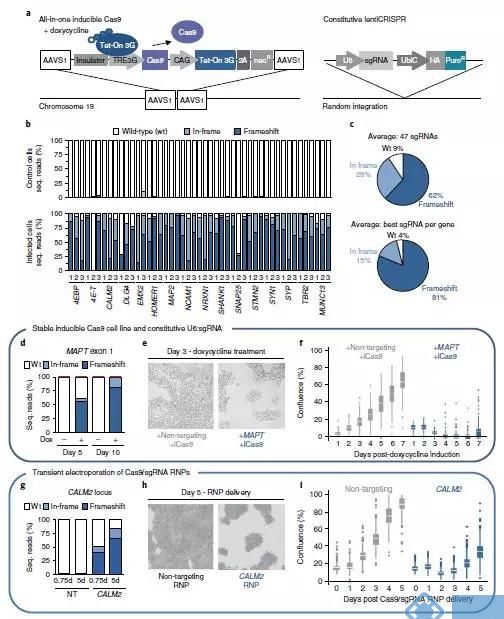
图一数据说明:基于CRISPR-Cas9的基因编辑会导致细胞毒性,抑制细胞生长。
图二数据说明:CRISPR-Cas9引起的这种细胞毒性反应是通过编辑过程中产生双链断裂(DSB)引起的。
图三数据说明:TP53(就是表达P53的那个基因)可能是Cas9相关双链断裂引起细胞毒性反应的关键。这个反应是它通过高表达P21来实现的。也就是跟文章一一样,是通过hold细胞周期来实现的。
图四数据说明:P53引起的毒性反应确实会阻止Cas9在人多能干细胞中进行基因编辑。注意这里说的基因编辑也是基于同源重组的基因编辑。
文章二的结论如下:
多个研究比较了不同细胞系插入删除及同源重组的效率,发现人多能干细胞比经过转化的细胞系效率低5到20倍。这些结果与我们观察到的平均低17倍类似。长期抑制P53可导致(细胞)突变负荷增加,但人多能干细胞对(P53的)瞬时抑制耐受。抑制P53可(通过提高编辑效率)减少其他产物,富集经编辑的人多能干细胞。
Cas9活动引起的毒性反应对以人多能干细胞为基础的疗法有重要的提示。抑制P53可降低毒性作用,但是却可能增加脱靶突变带来癌症风险。在体外编辑的时候,如果Cas9毒性作用与克隆性增殖相结合,就可能富集对DNA损伤更耐受的P53突变细胞。虽然在其他临床相关细胞种类中,P53突变细胞的比例还有待测定,但对于人多能干细胞,这一点需高度关注。在人胚胎干细胞细胞系中,P53突变的基础量就很高,据参考文献,3.5%的人独立胚胎干细胞系及多达29%常用于RNA-seq数据库的人胚胎干细胞具有P53突变。(因此)编辑患者细胞前,需充分评估风险和收益。评估经基因编辑的细胞P53自发突变(就是不管编辑不编辑都会发生的突变)的频率,以及与瞬时抑制P53相关的突变负荷。随着基于人多能干细胞的基因编辑疗法走向临床,不论是基因编辑前还是编辑后,确保患者细胞拥有功能性P53都是非常重要的。
端午节快乐,世界杯开心!!
想要了解基因编辑治疗行业发展和竞品信息
请长按二维码关注博雅辑因官方公众号
想快速学习基因编辑基础知识
精确认识基因编辑技术
长按二维码关注博雅辑因技术号
博雅辑因科技