2022年10月3日广州医科大学附属肿瘤医院尤强教授团队在国际期刊Theranostics 上发表了题为《Chitinase-3 like-protein-1 promotes glioma progression via the NF-κB signaling pathway and tumor microenvironment reprogramming》的文章。本文揭示了细胞核 CHI3L1 通过持续激活 NF-κB 信号通路促进肿瘤细胞增殖和存活。相比之下,CHI3L1 结合 CD44 激活 AKT 通路,促进 M2 巨噬细胞在分泌到 TME 后极化,TME 负责促肿瘤环境重编程。总之,该研究结果为 CHI3L1 作为神经胶质瘤治疗靶点的潜在作用提供了基础。

研究背景
胶质瘤是原发性中枢神经系统(CNS)肿瘤的一种异质性组,占所有脑肿瘤的80%。尽管有许多积极的联合治疗,包括手术、化疗和放疗,但5年总生存率(OS)仍然很低。因此,明确胶质瘤发生发展的关键分子和特异性机制将有助于准确诊断和治疗。
核因子NF-κB是一个转录因子家族,参与病毒感染、免疫应答、细胞增殖和存活以及肿瘤发生。肿瘤细胞内NF-κB通路的激活与肿瘤的发病机制和化疗耐药性有关,抑制NF-κB已被认为是抑制胶质瘤细胞增殖和存活的一种有吸引力的治疗方法。然而,脑胶质瘤细胞中负责NF-κB激活的关键调节因子仍然未知,需要进一步研究。
除了实质细胞外,肿瘤微环境(TME)中的免疫细胞也经历了大量的重编程,从而获得促肿瘤的表型,以促进肿瘤的进展。肿瘤相关巨噬细胞(TAMs)是肿瘤相关巨噬细胞中的大多数免疫细胞,促进免疫逃逸和肿瘤进展。胶质瘤中的TAMs包括小胶质细胞或单核细胞来源的群体,而极化的M2 TAMs通过影响干细胞表型转换、血管生成和细胞因子释放来促进胶质瘤的生存和生长。TAMs通过C-C基序趋化因子受体2/C-C基序趋化因子配体2(CCL2)途径抑制、表型转换和集落刺激因子1受体阻断而成为恶性胶质瘤的治疗靶点。确定M2 TAMs极化的参与者对胶质瘤治疗有重要意义。
几丁质酶3样蛋白1(CHI3L1)是糖苷水解酶家族18的一员,在氧化损伤、凋亡、焦下垂、细胞外基质调节、Th1/Th2炎症平衡和实质瘢痕形成等方面起着重要作用。非酶CHI3L1在各种癌症中高表达,如肺癌、结肠癌、胃癌和乳腺癌,并与癌症患者的低存活率有关。尤其是上调的CHI3L1和CD44被认为是间充质(MES)胶质瘤的标志物,其主要表现为NF-κB激活。CHI3L1在胶质瘤中如何驱动NF-κB通路激活并参与TME重编程,包括TAMS极化和血管生成等机制有待进一步研究。
本文分析了GEO、肿瘤基因组图谱(TCGA)和中国胶质瘤基因组图谱(CGGA)的mRNA-SEQ数据,从mRNA水平探讨CHI3L1在胶质瘤中的表达谱。采用免疫组化(IHC)、酶联免疫吸附试验(ELISA)和Western blot检测CHI3L1蛋白水平。用Spearman相关分析法探讨CHI3L1表达与免疫细胞浸润的关系。应用单细胞RNA-SEQ数据来表征肿瘤细胞的行为和描绘髓系细胞的景观。通过4株胶质母细胞瘤(GBM)细胞株和动物实验,进一步研究了CHI3L1在胶质瘤生存、增殖和侵袭中的作用。
1. CHI3L1在脑胶质瘤中高表达与OS恶化相关
文章分析了TCGA、泛癌和GTEX(共15776例)的mRNA数据,比较了CHI3L1在33种肿瘤和配对正常组织中的表达水平。CHI3L1在癌组织中的表达高于癌旁组织。与其他肿瘤类型相比,GBM是CHI3L1表达最高的肿瘤类型。为了进一步了解CHI3L1表达与胶质瘤表型的关系,作者从GEO、TCGA和CGGA数据库中提取了具有详细临床信息的mRNA微阵列或测序病例。与正常脑胶质瘤患者相比,CHI3L1在肿瘤中过度表达,并且随着脑胶质瘤级别的增加,CHI3L1的表达水平增加。此外,ELISA检测胶质瘤患者血清CHI3L1水平高于健康对照组。IHC显示CHI3L1在分期胶质瘤中富集,特别是在高级别胶质瘤(HGG)(WHOIII-IV)中。Western blot还证实CHI3L1在肿瘤部位比瘤周核心显著上调,其表达随着Giloma WHO分级的增加而增加。在TCGA和CGGA中,由于CHI3L1被证明是一种炎症和肿瘤的生物标志物,作者绘制ROC曲线并计算曲线下面积(AUC)来评价CHI3L1对胶质瘤的诊断价值,一年后的AUC值分别为0.852和0.741。Kaplan-Meier分析显示,脑胶质瘤患者CHI3L1水平升高与无进展生存率(PFS)和OS发生率降低有关。对于GBM细胞系的基因表达谱,从CCLE网站获得五个GBM细胞系的数据,以比较CHI3L1的表达。蛋白水平方面,Western blot结果显示,U87和A172细胞的CHI3L1蛋白水平高于U251和U118细胞。总之,CHI3L1在肿瘤部位高表达,并与胶质瘤患者的不良生存密切相关。

2. 胶质瘤中CHI3L1的表达与NF-κB通路的激活有关
恶病质信号通路的异常激活有助于神经胶质瘤的进展。因此,作者分析了GEO、TCGA和CGGA队列,以确定胶质瘤中的激活通路。在GSE100675中,火山图和热图显示625个上调基因和803个下调基因(logfc=1)。为了进一步分析这一特征,作者进行了基因本体论 (GO) 和基因集富集分析 (GSEA),分别将细胞周期检查点和 NF-κB 信号通路确定为最显着富集的功能术语和通路。热图中显示了正常、肿瘤周围和肿瘤内组织中 NF-κB 通路的靶基因。在 TCGA 队列中,作者在神经胶质瘤患者中鉴定了 2546 个上调基因和 1647 个下调基因。CHI3L1 在 TCGA 群组的火山图和热图上被绘制为过度表达的基因。为了更好地表征 CHI3L1 表达与 NF-κB 通路富集之间的关系,作者应用 Hallmark 基因集的基因集变异分析 (GSVA) 来获得特定通路的定量分析。通过 NF-κB 通路的 TNFɑ 信号在肿瘤部位显着富集。总之,基于转录组数据的综合分析表明,CHI3L1 促进了 NF-κB 通路的激活,在神经胶质瘤的进展过程中充当帮凶。
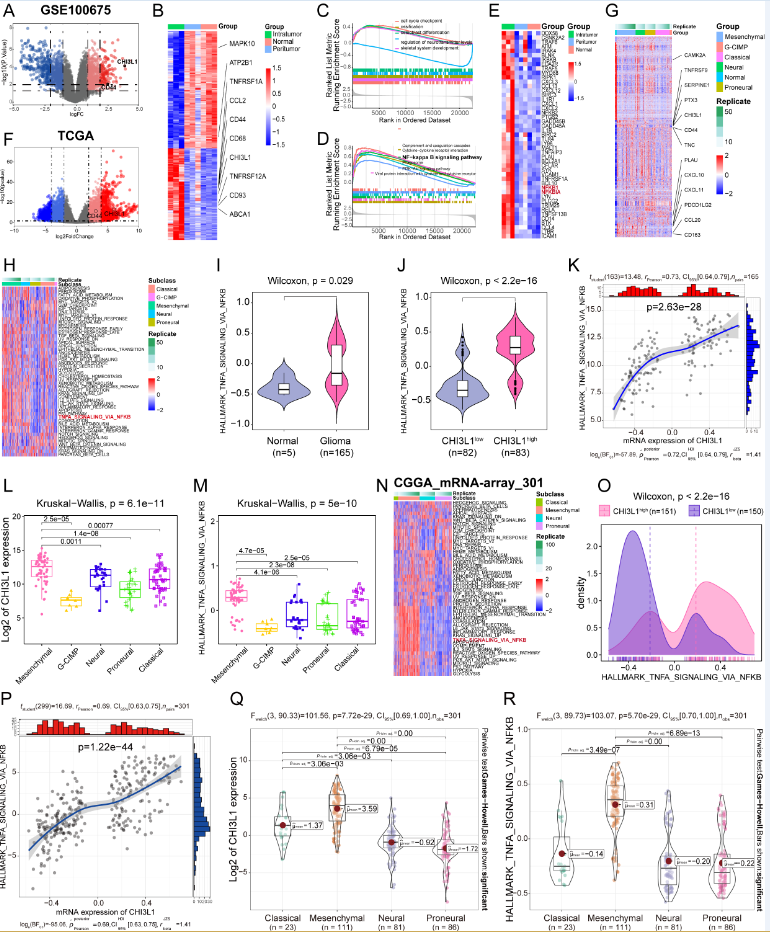
3. CHI3L1high特异性神经胶质瘤细胞在单细胞水平上主导神经胶质瘤中 NF-κB 通路的激活
作者分析了多区域神经胶质瘤单细胞转录组测序数据。从 GEO 数据库进一步了解细胞调节神经胶质瘤中 NF-κB 通路激活的机制。对总细胞群的UMAP分析确定了 17 个子簇,包括免疫细胞(骨髓和 T 细胞:sc-0、8 、-9 和 -14;分别为 sc-12)、脑细胞(sc-1、-4、-5、-7、-13)、肿瘤细胞(sc-2、-3、-6、-10 , 和 -11), 和小胶质细胞 (sc-15), 而 sc-16 种群太小而无法进行有意义的定义, 主要由它们的谱系身份隔离。细胞亚群的标记基因呈现在小提琴图中。令人惊讶的是,CHI3L1 优先在神经胶质瘤细胞中表达,其次是中性粒细胞。作者鉴定了两种不同类型的肿瘤细胞,它们显示出高水平的神经胶质瘤标志物:CST3、CCT6A、EGFR、MT1X、HOPX、FABP5、CHI3L1、GFAP、SPARCL1、ATP1A2、AQP4、PDGFRA、BCAN 和 SCG3。其中cluster 10被定义为CHI3L1高表达的CHI3L1high肿瘤细胞,其他归为CHI3L1low组。在 TME 中,与瘤周核相比,中性粒细胞显着增加,单核细胞急剧减少。为了便于比较,作者将来自正常和肿瘤周围部位的细胞群合并为一个新组,该组被定义为非肿瘤。作者首先关注 CHI3L1 表达对恶性细胞中 NF-κB 通路激活的作用。GSVA 表明,CHI3L1high 神经胶质瘤细胞通过 NF-κB 通路显着富集 TNFɑ 信号,而 CHI3L1low 神经胶质瘤细胞表现出抑制的 NF-κB 通路富集。

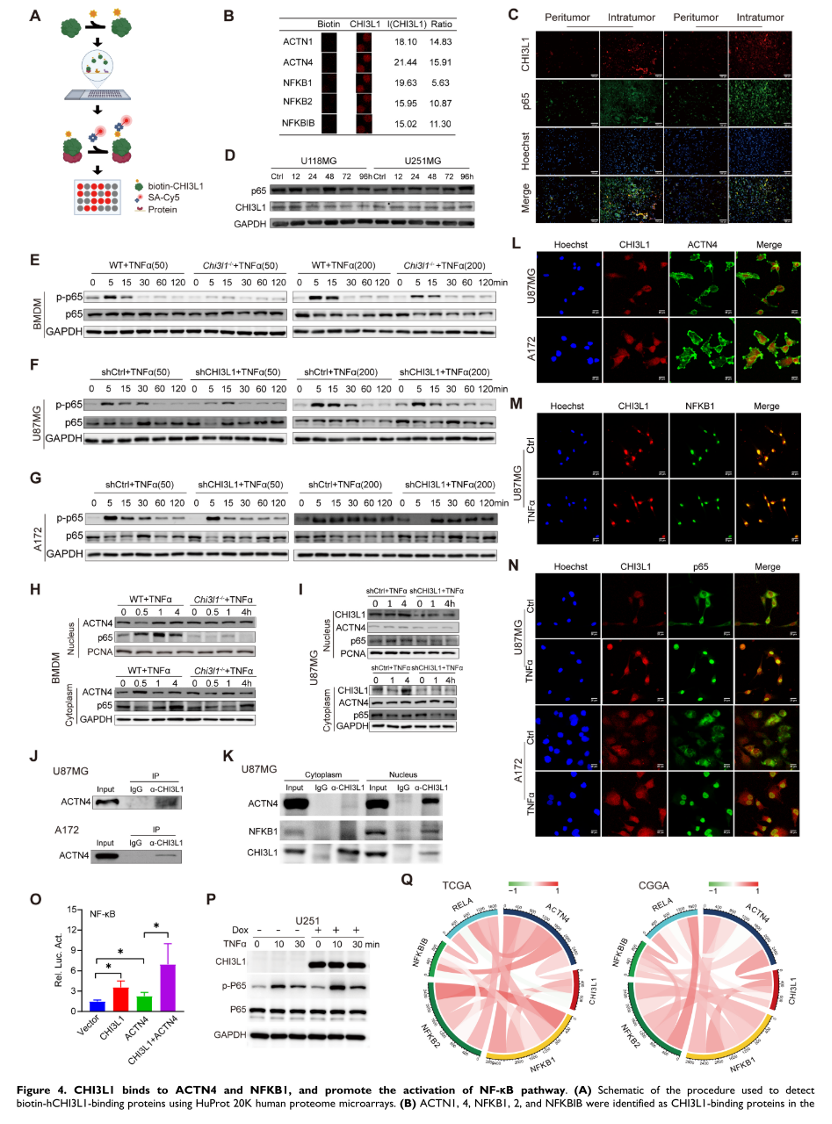
4. CHI3L1结合ACTN4 和NFKB1,通过促进NF-κB亚基核转位增强NF-κB 信号通路
HuProt 20K 人类蛋白质组微阵列包含超过 21,000 种亲和纯化的 GST 标记蛋白,用于鉴定 CHI3L1 结合蛋白,并鉴定了 238 种蛋白质。有趣的是,ACTN1、4、NFKB1、2 和 NFKBIB 被认为是相互结合。此外,作者对肿瘤内和成对的肿瘤周围组织的冷冻切片进行了 IF 染色,并证实了神经胶质瘤中 CHI3L1 和 NF-κB p65 表达之间的正相关。TNF 是激活转录因子 NF-κB 的主要炎症细胞因子。因此,用 TNFα 处理 U118MG 和 U251MG 细胞长达 4 天,以确定 CHI3L1 表达是否依赖于神经胶质瘤中 NF-κB 通路的持续激活。然后,作者在时间梯度中用低 (50 ng/mL) 和高 (200 ng/mL) 浓度的 TNFα 处理 WT 和 Chi3l1-/- BMDM,从 Chi3l1-/- BMDM中的 5 分钟起,p65 亚基的磷酸化明显受到抑制。此外,作者分离了细胞核和细胞质蛋白,以探索 CHI3L1 如何影响 NF-κB p65 亚基的磷酸化和核转位。蛋白质印迹显示在用 TNFɑ 处理 0.5 至 4 小时后,Chi3l1-/-BMDMs 中 p65 核转位明显减少,而 ACTN4 显示细胞质和细胞核没有变化。同样,用 shCHI3L1 转染的 U87MG 细胞在 TNFɑ 处理后具有较少的核 p65 和未改变的ACTN4。此外,作者发现CHI3L1在U87MG和A172细胞系中与ACTN4共免疫沉淀。作者进一步证明了 CHI3L1 在 U87MG 细胞的细胞质和细胞核中都与 ACTN4 结合,主要是在细胞核中。此外,双荧光素酶测定表明,用 CHI3L1 或 ACTN4 转染可增强 NF-kB 启动子依赖性荧光素酶活性。此外,与单独的 ACTN4 相比,CHI3L1和ACTN4的组合显着增加了荧光素酶活性。此外,作者在 U251 细胞中应用了 dox 诱导型 CHI3L1 表达系统。如图 4P 所示,dox 诱导的 CHI3L1 表达也增强了 TNFα 对 NF-kB 的激活。Pearson 相关分析表明,在 TCGA 和 CGGA 神经胶质瘤队列中,CHI3L1 和 ACTN4、NFKB1 或 NFKB2 之间存在强正相关。
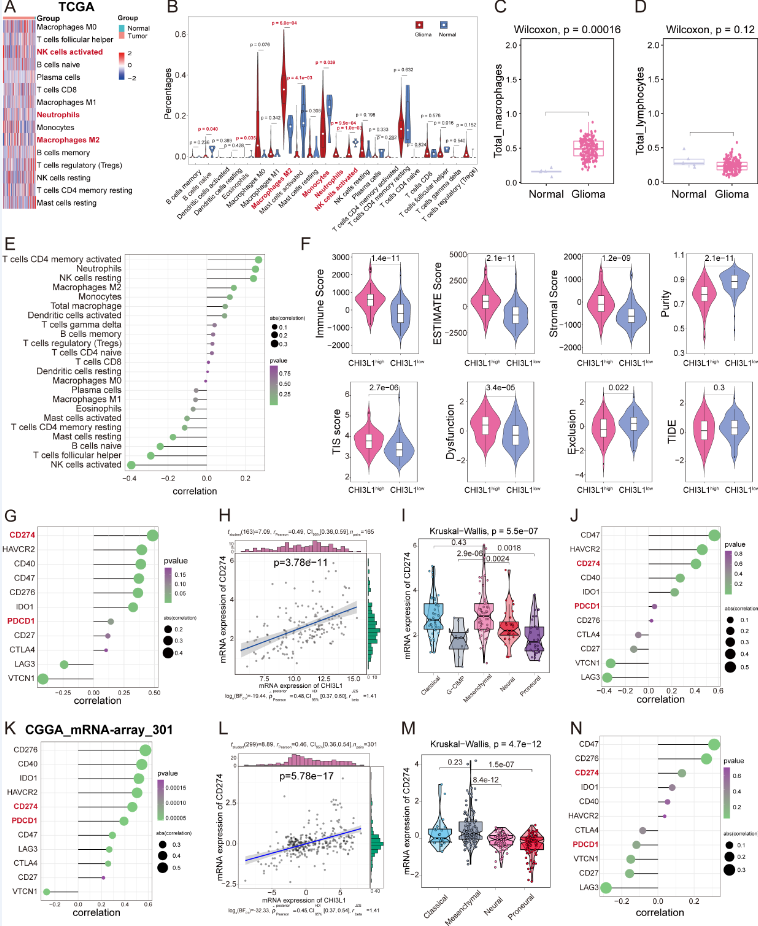
5.CHI3L1将TME重编程为胶质瘤中的免疫抑制表型
作者根据 LM22 特征矩阵使用 Cibersort 算法推断了 TCGA 队列样本中 22 种浸润免疫细胞的绝对水平。作者发现肿瘤中的中性粒细胞和 M2 巨噬细胞显着增加,而 B 细胞、单核细胞、激活的 NK 细胞和 T 细胞滤泡辅助细胞显着减少。接下来,将M0、M1和M2巨噬细胞的总和定义为总巨噬细胞,胶质瘤呈现出比正常组织更高的总巨噬细胞浸润。同样,作者将 B 和 T 细胞亚群分类为总淋巴细胞,发现正常和胶质瘤部位的总淋巴细胞没有差异。Spearman相关分析显示,CHI3L1表达与中性粒细胞和巨噬细胞M2浸润呈正相关,NK细胞活化与CHI3L1表达呈负相关。此外,作者还基于 TCGA 和 CGGA 数据集探讨了 CHI3L1 在调节胶质瘤免疫检查点表达中的作用。
6. 人脑胶质瘤髓系景观在单细胞水平上的表达
为了更好地表征神经胶质瘤中骨髓细胞群的特定表型和功能,作者分析了一个公共单细胞 RNA-seq 数据集。作者首先关注单核细胞、小胶质细胞和巨噬细胞轴,最终确定了九个亚群。应用 GSVA 可视化富集通路,上皮间质转化 (EMT) 和血管生成通路在巨噬细胞中显着富集。小胶质细胞是中枢神经系统中的一种巨噬细胞,在PI3K Akt mTOR途径中富集,该途径是由小胶质细胞介导的免疫抑制靶点。

7. CHI3L1与CD44 相互作用促进TME中的M2巨噬细胞极化
接下来,作者研究了胶质瘤细胞如何将CHI3L1分泌到细胞外空间。用丝状肌动蛋白(F-actin)、微管、非肌肉肌球蛋白Ⅱ(NMⅡ)、粘着斑激酶(FAK)和细胞骨架张力抑制剂测定所涉及的机械成分。CB预处理24h后,CHI3L1升高,促进F-肌动蛋白向球状肌动蛋白(G-肌动蛋白)的转化,降低F-肌动蛋白的含量。U87MG和A172细胞系中ACTN4和P65的表达无差异。CB处理U87MG和A172细胞后,CHI3L1在细胞核和细胞质中的表达均明显增加。然而,CB治疗后CHI3L1的表达水平没有显著性差异。因此,F-actin可能参与GBM肿瘤细胞胞外CHI3L1的分泌。TME中的TAMs一般分为两种表型:M1样(抗肿瘤、促炎)和M2样(促肿瘤、抗炎)。冰冻切片发现CHI3L1和CD206的同时高表达与肿瘤分级呈正相关,在GBM组织中不共定位。作者用IL-4、重组人CHI3L1(rhCHI3L1)和U87-MG和A172细胞培养上清液处理THP1。IF分析显示,rhCHI3L1和培养上清都有助于巨噬细胞从M0表型向M2表型的极化。同时,QPCR结果显示,巨噬细胞M2标记物(IL-10、CD163、MRC1、ARG1和RetNLB)在IL-4、RhCHI3L1及U87-MG和A172细胞培养上清后mRNA表达明显增加,而M1标记物(HLA-DR、IL-1β、CD68、CD80、NOS2和MCP-1)无差异或略有改变。
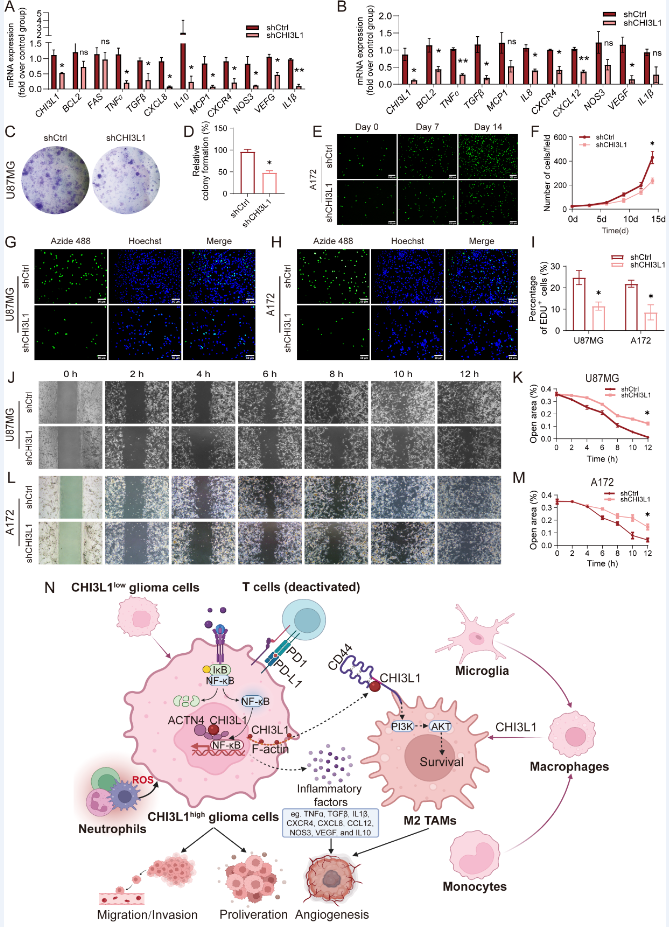
8. CHI3L1对胶质瘤细胞增殖、迁移和存活的调节作用
接下来,作者发现 CHI3L1 的敲低导致 U87MG 和 A172 细胞系中炎症因子(如 TNFɑ、TGFβ、CXCR4、CXCL12、CCL2、CXCL8、NOS3 和 IL1β)的 mRNA 表达降低。此外,由于在克隆形成和 EdU 增殖测定中敲低 CHI3L1,U87MG 和 A172 细胞均显示增殖率和存活率降低。CHI3L1 敲低的神经胶质瘤细胞也显示出迁移能力降低。同时,经shCHI3L1慢病毒敲除CHI3L1的U87MG细胞的生长速度较慢。然后在裸鼠皮下注射U87MG细胞。结果CHI3L1基因敲除组肿瘤生长速度较慢,肿瘤大小也较对照组小。总之,体内和体外研究都表明CHI3L1调节胶质瘤细胞的增殖、迁移和存活。
结 论该研究表明CHI3L1促进了胶质瘤细胞内NF-κB通路的激活,并对TME进行了重新编程,因此是一个有希望的治疗胶质瘤的靶点。
吉凯助力
本文中CHI3L1干扰慢病毒由吉凯基因提供,在体内体外实验中均有很好的敲低效率。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
作者简介
赵婷,复旦大学附属肿瘤医院内科基地住院医师,复旦大学2022年“卓医计划”临床博士后,2020年获国家留学基金委公派留学赴新加坡国立大学国际癌症中心博士联合培养。博士期间发表第一作者及共同第一作者IF>10的SCI论文4篇,申报国jia级发明**1项。在校期间主持江苏省研究生科研创新计划3项,参与国家自然科学基金面上项目3项,荣获国家奖学金4次及江苏省优秀学生干部等荣誉和奖励60余项。
