导 语
肿瘤转移是癌症治疗的最大挑战之一,而细胞侵袭实验是研究癌细胞迁移能力的“黄金标准”!如何利用基质胶精准构建体外侵袭模型?实验关键步骤与试剂如何选择?翌圣生物本期技术专栏为您揭晓答案!
PART.01
细胞侵袭实验
细胞侵袭实验通过模拟癌细胞穿透基底膜的过程,评估其迁移与侵袭能力,广泛应用于抗肿瘤药物筛选、转移机制研究及靶向治疗开发。实验中,基质胶(如翌圣生物Ceturegel®基质胶)作为基底膜替代物,为细胞提供三维微环境,结合Transwell小室形成物理屏障,通过量化穿透基质的细胞数评估侵袭性。
实验优势:
✅ 高灵敏度:可检测微量药物对侵袭的抑制作用
✅ 可视化强:通过染色直接观察侵袭细胞
✅ 适用性广:支持多种肿瘤细胞
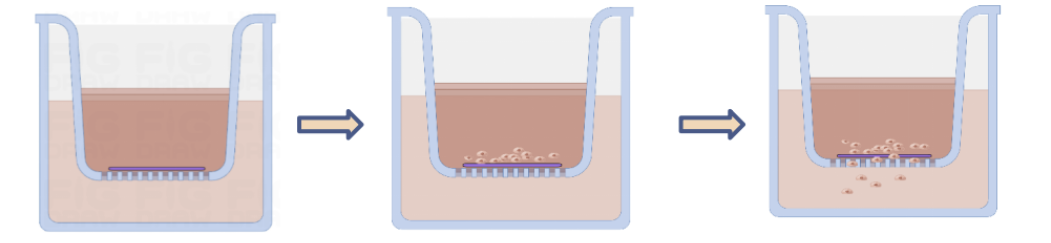
图1.细胞侵袭实验过程
PART.02
实验步骤
首先将拿到的Ceturegel®基质胶冻融后按照原液1:8稀释(终浓度不要超过3 mg/mL)来包被Transwell小室底部膜的上室面,置37℃、30 min - 8 h使基质胶聚合成凝胶,使用前用无血清培养基进行基底膜水化30 min。
将细胞饥饿12 - 24 h以去除血清的影响。
消化细胞,终止消化后离心弃去培养液并用PBS洗1 - 2次,用含无血清培养基重悬调整细胞密度至4×104~5×105个/mL 。。
取细胞悬液100 μL加入Transwell小室。
在24孔板下室加入600 μL含20%FBS培养基,添加时要避免下层培养液和小室间产生气泡,产生气泡易使下层培养液的趋化作用减弱甚至消失。
培养细胞:常规培养12 - 48 h(时间主要依癌细胞侵袭能力而定)。
取出Transwell小室,弃去孔中培养液,用不含钙的PBS清洗2遍,4%多聚甲醛固定10 - 30 min,将小室适当风干。
使用0.1%结晶紫染色5 - 20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍于显微镜下随即5个视野观察细胞,记数。
PART.03
实验结果
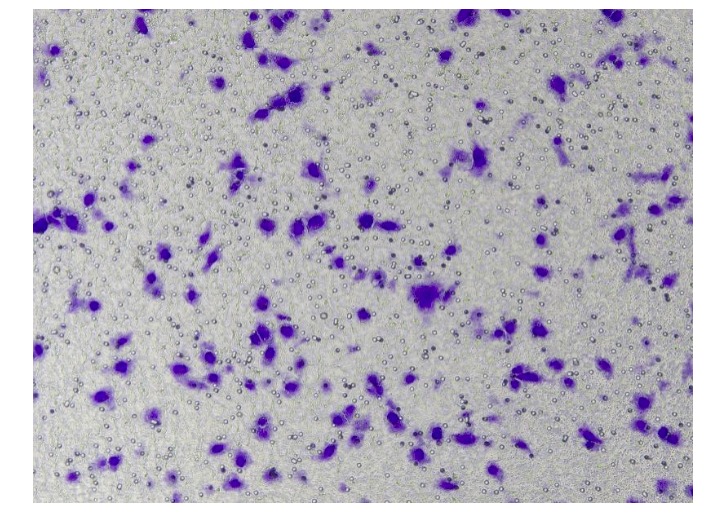
图2.细胞侵袭后经结晶紫染色的结果
PART.04
常见问题及解答
细胞不转移?
QA
①细胞侵袭转移能力比较弱。
②基质胶浓度不佳铺的太厚,需要做预实验摸索。
③细胞给的量少可尝试增加细胞数量。
④细胞没有用PBS洗1-2 遍,用胰酶消化后,必须将含血清的培养基洗去。
⑤细胞的活性太差,活性不好的细胞做侵袭实验难度较大。
染色后细胞分布不均一?
QA
①小室未平衡放置于孔板中。
②细胞悬液加入时局部过多。
③小室有倾斜或晃动。
④小室本身渗透膜不平。
PART.05
产品详情
|
产品名称 |
货号 |
规格 |
|
Ceturegel® Matrix LDEV-Free基质胶 |
40183ES |
1.5 mL/5 mL/10 mL |
|
PerfCell™ Trypsin (0.25%), phenol red胰酶溶液(0.25%),含酚红 |
40126ES |
100 mL |
|
Fetal Bovine Serum Gold 胎牛血清(特级) |
40130ES |
50 mL/500 mL |
|
PBS(1×)细胞培养级 |
41403ES |
500 mL |
|
0.5%结晶紫染色液 Crystal Violet Stain Solution |
60506ES |
100 mL |
|
24孔细胞小室,PC膜,8μm,灭菌,TC处理 |
84052ES |
12个/板 |
|
24孔细胞小室,PET膜,8μm,灭菌,TC处理 |
84051ES |
12个/板 |
