随着肿瘤免疫治疗的高速发展,越来越多的创新疗法进入到临床。越来越多的临床数据和临床试验表明,针对肿瘤的有效疗法越来越需要整合创新的多种技术,共同抗癌,溶瘤病毒(Oncolytic Virus,OVs)就是典型的、整合多种治疗手段的、多机制的肿瘤免疫治疗创新药物代表。
在肿瘤内部具备独立的微环境,其中恶性增值的肿瘤细胞和支持细胞通过直接联系,或通过生长因子、代谢产物、细胞外囊泡(如外泌体)的分泌完成细胞间信号传递,用于肿瘤细胞的生长和对治疗性药物的抵抗。与此同时,人们也发现可复制性的病毒,如溶瘤病毒,能够利用细胞外囊泡将自身编码的基因传递到其他未被病毒感染的细胞中,从而促进病毒的扩增、传播。
那么,在基于OVs的肿瘤治疗中,是否可以借助OVs编码基因并释放的特点,影响未被感染的细胞中,促进溶瘤病毒的疗效?
2022年4月7日,加拿大University of Ottawa的Carolina S. Ilkow教授研究团队在Nature Communications杂志发表他们的最近工作“Virally programmed extracellular vesicles sensitize cancer cells to oncolytic virus and small molecule therapy”,他们发现了一种新的人工合成的amiRNAs可以显著促进溶瘤病毒及小分子疗法的肿瘤杀伤效果。
在过去的研究中,Carolina S. Ilkow教授团队发现表观遗传学修饰的药物能够增强溶瘤病毒对肿瘤细胞的杀伤效应,这促使他们寻找人为改变基因表达的办法,来增强肿瘤细胞中溶瘤病毒的复制。
作者首先借助编码靶向16000个哺乳动物基因的人工合成miRNA(artificial microRNAs,amiRNAs)复制型Sindbis virus (SV)文库,感染人和小鼠肿瘤细胞系、肿瘤相关成纤维细胞(CAFs)和正常皮肤成纤维细胞,借助二代测序手段筛选能够在肿瘤细胞中增强病毒复制的amiRNAs。作者发现了五种肿瘤细胞中富集的amiRNA,进一步结合溶瘤水疱性口炎病毒(VSVΔ51)的实验显示,携带amiR-4的VSVΔ51溶瘤病毒能够显著产生更强的肿瘤杀伤能力,且对正常细胞的影响与单纯VSVΔ51类似,提示amiR-4的溶瘤病毒肿瘤杀伤能力增强效应。
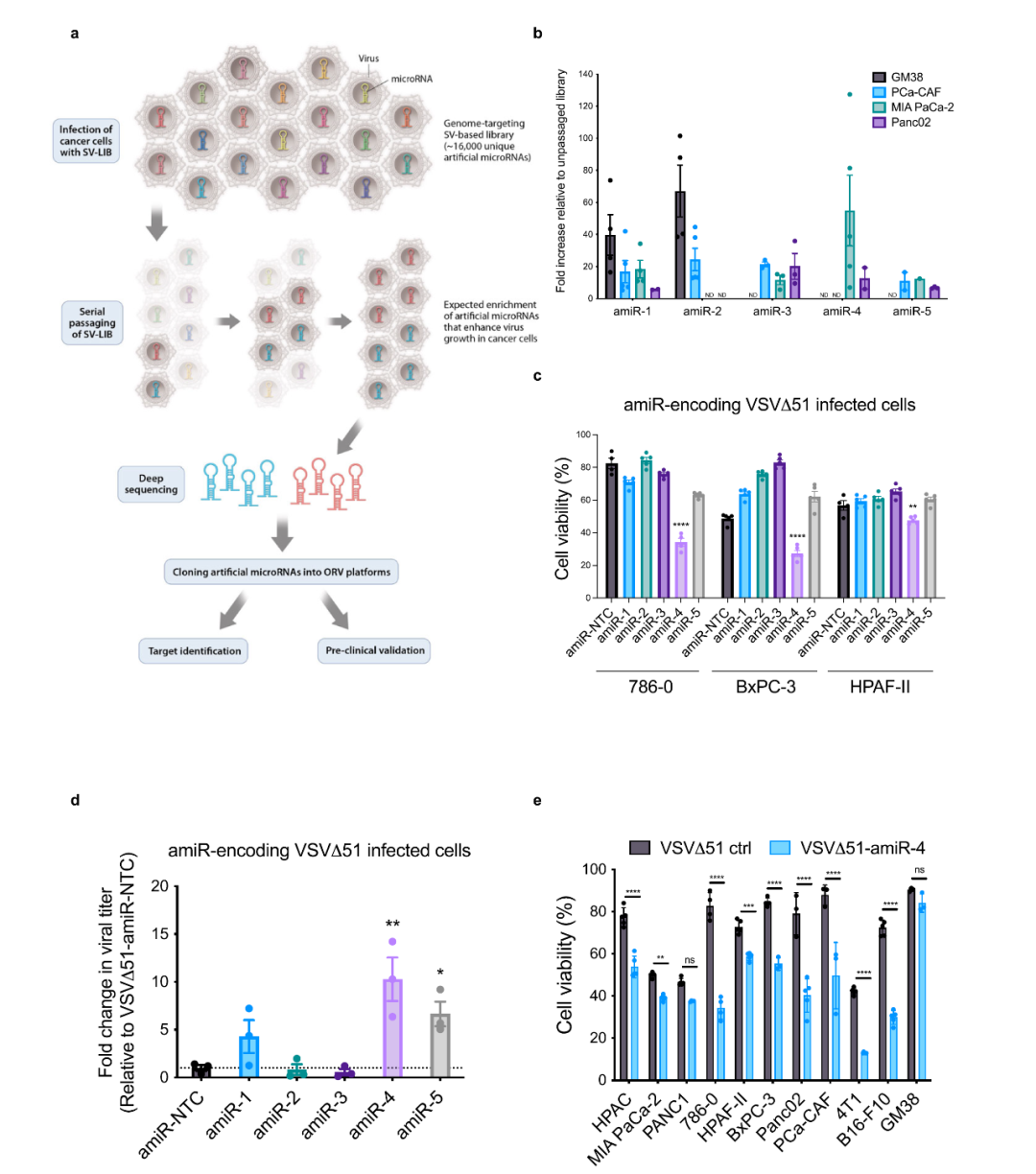
amiR-4通过什么途径产生如此效应?
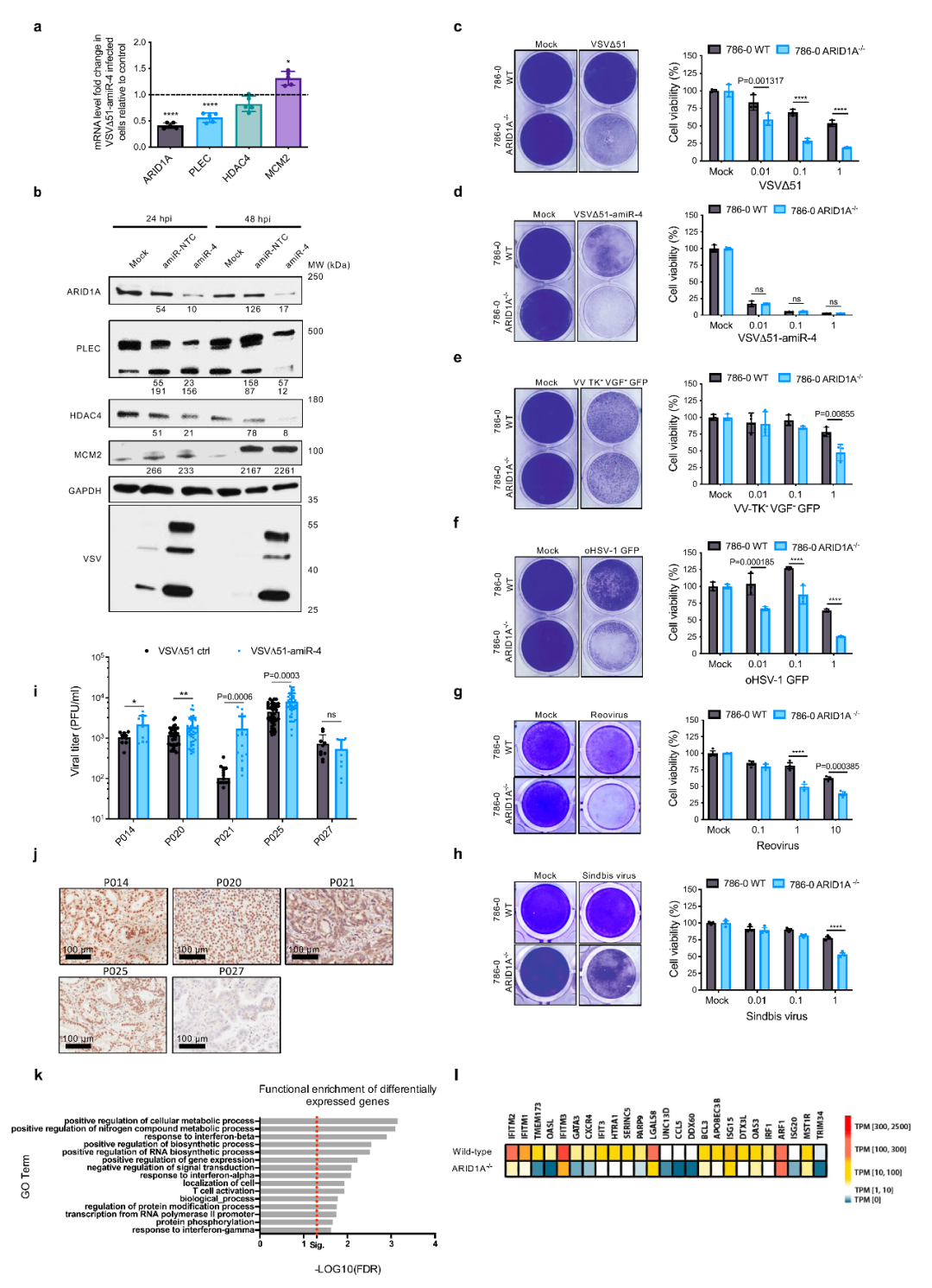
接下来,作者通过生信分析和实验,发现amiR-4可能通过下调ARID1A、HDAC4和PLEC基因的表达来增强溶瘤病毒的生长和肿瘤细胞杀伤。在过去的研究中,人们已经发现PLEC基因的变化会影响细胞骨架组分,从而影响溶瘤病毒特性;同时,HDAC4基因的下调同诸多组蛋白脱乙酰基酶类的下调一样可以增强溶瘤病毒复制,然而,ARID1A基因的变化如何影响溶瘤病毒尚不清楚。
因此,作者借助CRISPR-Cas9基因编辑技术,研究了ARID1A基因缺失的肿瘤细胞系的变化,发现ARID1A基因缺失会导致细胞对VSVΔ51的杀伤敏感性提升(图2c)。重要的是,这种提升并不只针对VSVΔ51,作者发现,ARID1A基因缺失会导致细胞对溶瘤痘病毒(VV-TK−VGF−)、溶瘤I型疱疹病毒(oHSV-1)等多种病毒的敏感性均提升(图2e-h),且胰腺癌肿瘤组织的PDX模型实验也印证了ARID1A基因下调促进溶瘤病毒杀伤(图2i-j)。综上,作者发现了ARID1A基因在溶瘤病毒杀伤肿瘤细胞过程中的突出作用。
进一步,作者发现携带amiR-4的溶瘤病毒与小分子抑制剂GSK126联合使用能够进一步增强肿瘤细胞杀伤效应,这种效应是通过ARID1A与EZH2基因的互相作用导致的合成致死而产生。但是,由于GSK126并不会增强病毒的产量,那么这种联合使用导致的更强作用如何发生?
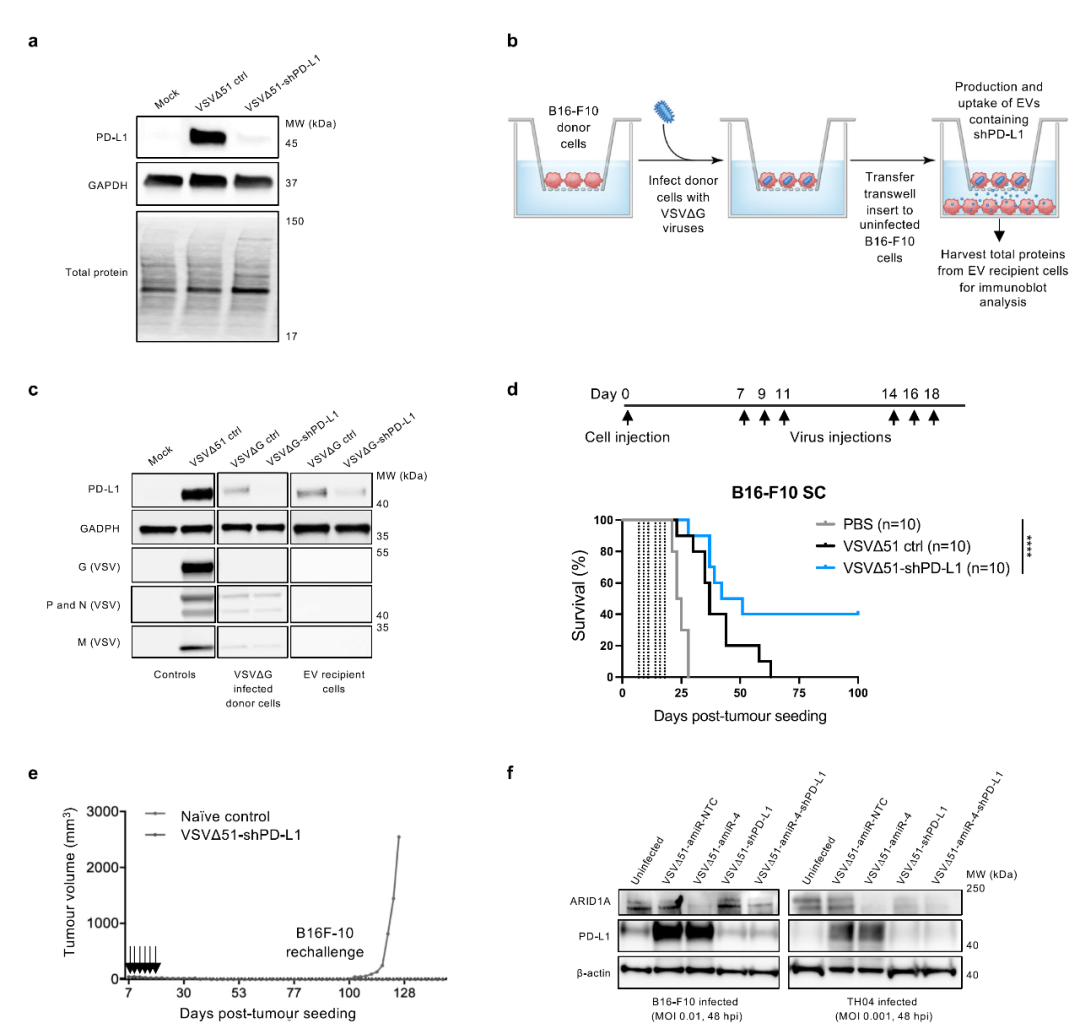
因此,作者猜测,负责细胞间信号传递的细胞外囊泡,如外泌体,在其中起到重要作用。与猜测类似,他们发现溶瘤病毒感染的肿瘤细胞外泌体分泌增多,通过外泌体分离、鉴定、示踪等一系类实验,他们发现携带amiR-4的溶瘤病毒感染肿瘤细胞后,细胞分泌的外泌体含有amiR-4,且能够传递给其他未被溶瘤病毒感染的细胞,在GSK126的联合使用下,这套系统会产生强肿瘤杀伤能力(图3)。文中,作者在体内的实验中同样验证了此效应。

最后,作者进一步研究携带amiR-4的溶瘤病毒联合免疫检查点疗法的效果,发现同时携带PD-L1干扰序列和amiR-4的溶瘤VSVΔ51病毒能够同时导致ARID1A和PD-L1的基因下调,进而高效杀伤肿瘤细胞(图4)。
综上所述,Carolina S. Ilkow教授研究团队为我们描述了一副联合多种治疗手段的溶瘤病毒整合疗法,并对其中信号传递机制、细胞杀伤机制进行了探索。未来,在研究肿瘤微环境中的细胞通讯、探索新型的肿瘤治疗疗法等工作中,基于合成的miRNA文库筛选、外泌体示踪等多技术将带来更多发现。
参考文献:
Marie-eve Wedge, et al., Virally programmed extracellular vesicles sensitize cancer cells to oncolytic virus and small molecule therapy, Nature Communications, (2022) 13:1898 | https://doi.org/10.1038/s41467-022-29526-8 助力肿瘤科学研究和临床转化,和元生物能够为您提供工具病毒载体制备、外泌体分离鉴定示踪、临床级溶瘤病毒GMP生产等多样化全面服务,欢迎联系。


