药物滥用(如可卡因、阿片类药物)最初会带来急性奖赏效应,即药物的正性强化效应,用药后导致大脑功能的适应性变化,且这种快感驱使个体进一步摄取药物;停药后个体会产生不适的身体反应以及烦躁、抑郁、易怒、焦虑等负面情绪。个体为了缓解这种不适会进一步获药,即负性强化效应。正性强化和负性强化的循环交替促进药物依赖的状态。吗啡(morphine)是阿片类药物的一种。其衍生物盐酸吗啡是临床上最常用的镇痛剂,有极强的镇痛作用。然而,吗啡具有易成瘾这一危害极深的副作用。长期使用吗啡的患者会产生严重的依赖性,如果停止用药一段时间,会产生焦虑、抑郁等戒断反应。这些戒断反应会驱使患者使用更多吗啡,形成恶性循环,严重危害了公共健康。药物从最初奖赏过渡到药物依赖的过程伴随着大脑神经环路可塑性的改变,中脑边缘系统的重要脑区腹侧被盖区(ventral tegmental area, VTA)神经元可塑性参与调控阿片类药物依赖和戒断症状[1,2],然而,目前尚不清楚影响奖赏的正性强化和戒断诱发的负性强化之间转换的神经环路重塑机制。近日,复旦大学脑科学研究院马兰/王菲菲团队在Molecular Psychiatry发表题为CRHCeA→VTA inputs inhibit the positive ensembles to induce negative affect of opiate withdrawal的最新研究工作[3]。该研究借助即早基因驱动的标记技术标记了VTA中吗啡激活的奖赏神经元集群(吗啡神经元集群),发现中央杏仁核(central amygdala, CeA)中促肾上腺皮质激素释放激素(CRH)神经元通过抑制性环路调控VTA吗啡神经元集群,并介导吗啡戒断诱发的负性强化效应,阐明了成瘾性药物吗啡负性强化环路和分子机制,为治疗成瘾、防止药物滥用提供新的干预靶点,具有重要科学和社会意义。
1.VTA吗啡神经元集群以多巴胺依赖机制介导正性强化
首先,研究人员借助响应神经元活性的功能元件--E-SARE(synaptic activity-response elements, AAV-E-SARE-CreERT2)标记中脑边缘系统的重要脑区腹侧被盖区(ventral tegmental area, VTA)吗啡初次暴露激活的神经元集群(Mor-Ens, 吗啡神经元集群),发现VTA吗啡神经元集群偏向性地投射到伏隔核(the nucleus accumbens, NAc)脑区(图1a-f)。
随后,研究人员在小鼠VTA区注射AAV-E-SARE-CreERT2和AAV-DIO-hChR2-mCherry混合病毒并埋入光纤,借助颅内自身刺激(intracranial self-stimulation, ICSS)系统发现,光激活VTA吗啡神经元集群可引起小鼠鼻触反应次数增加,使用氟哌噻醇(flupenthixol 多巴胺拮抗剂)可抑制这一现象(图1g-j)。同时,借助DA探针发现激活VTA吗啡神经元集群能够促进NAc多巴胺的释放(图1k-o)。上述结果提示了VTA吗啡神经元集群偏向性地投射到伏隔核(NAc)脑区,激活VTA吗啡神经元集群能够促进NAc多巴胺的释放,引发小鼠的自给光行为,介导了多巴胺依赖的正性强化效应。
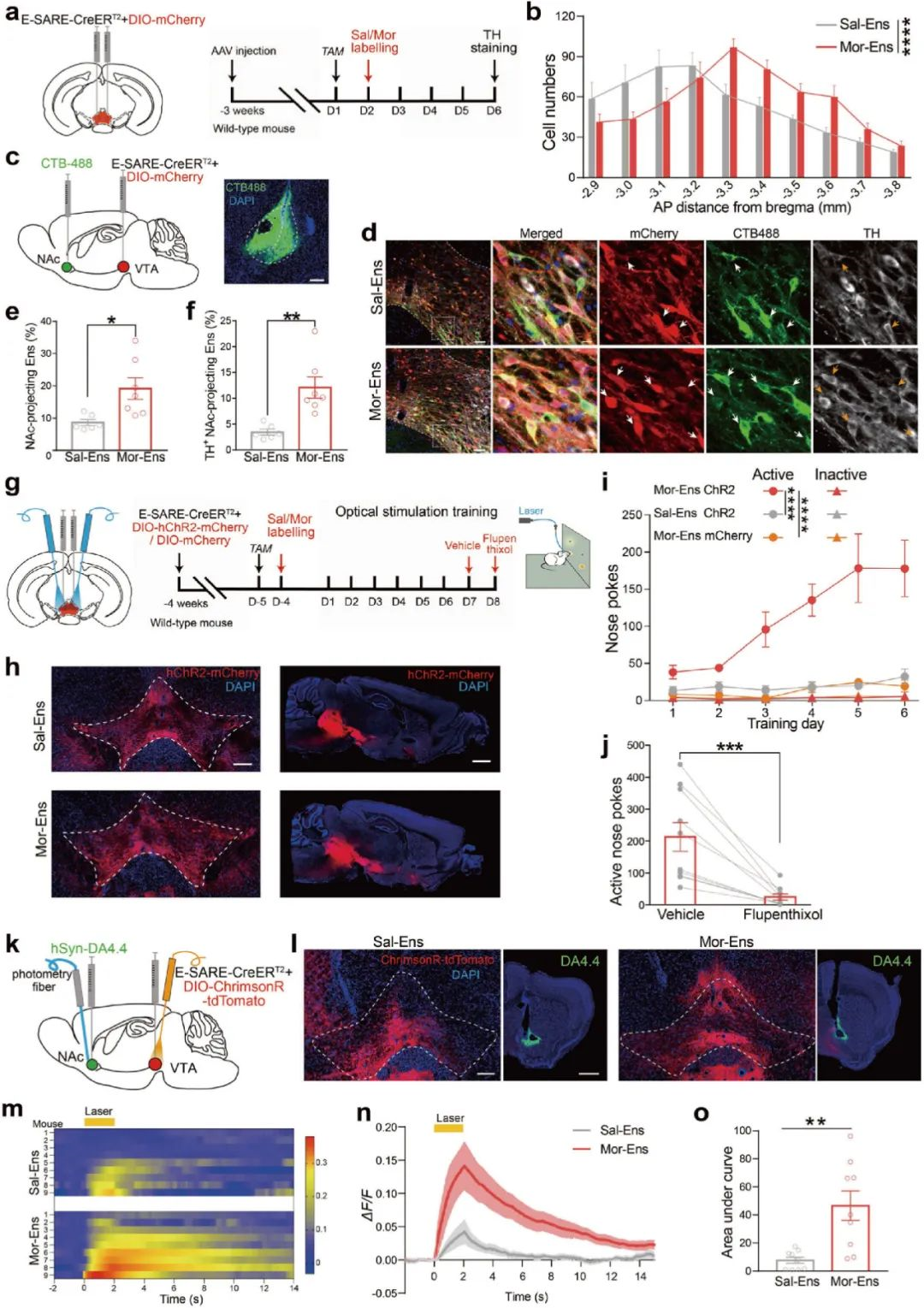
图1 VTA吗啡神经元集群以多巴胺依赖机制介导正性强化
2.VTA吗啡神经元集群接收的抑制性输入增强,介导戒断诱发的负性强化
接下来,借助全细胞膜片钳记录发现,在慢性吗啡暴露条件下,TH阳性VTA吗啡神经元集群的mIPSC振幅和频率显著增加,提示了VTA多巴胺能吗啡神经元集群接受更多的抑制性输入(图2a-i)。
随后,借助化学遗传学技术和行为学范式发现,hM4Di抑制VTA吗啡神经元活性会加重吗啡戒断诱发的条件位置厌恶和焦虑行为,而hM3Dq激活吗啡神经元集群能够缓解吗啡戒断带来的厌恶和焦虑负性情绪(图2j-w),提示了编码吗啡奖赏的正性神经元集群功能受到抑制,是导致吗啡负性强化的原因。
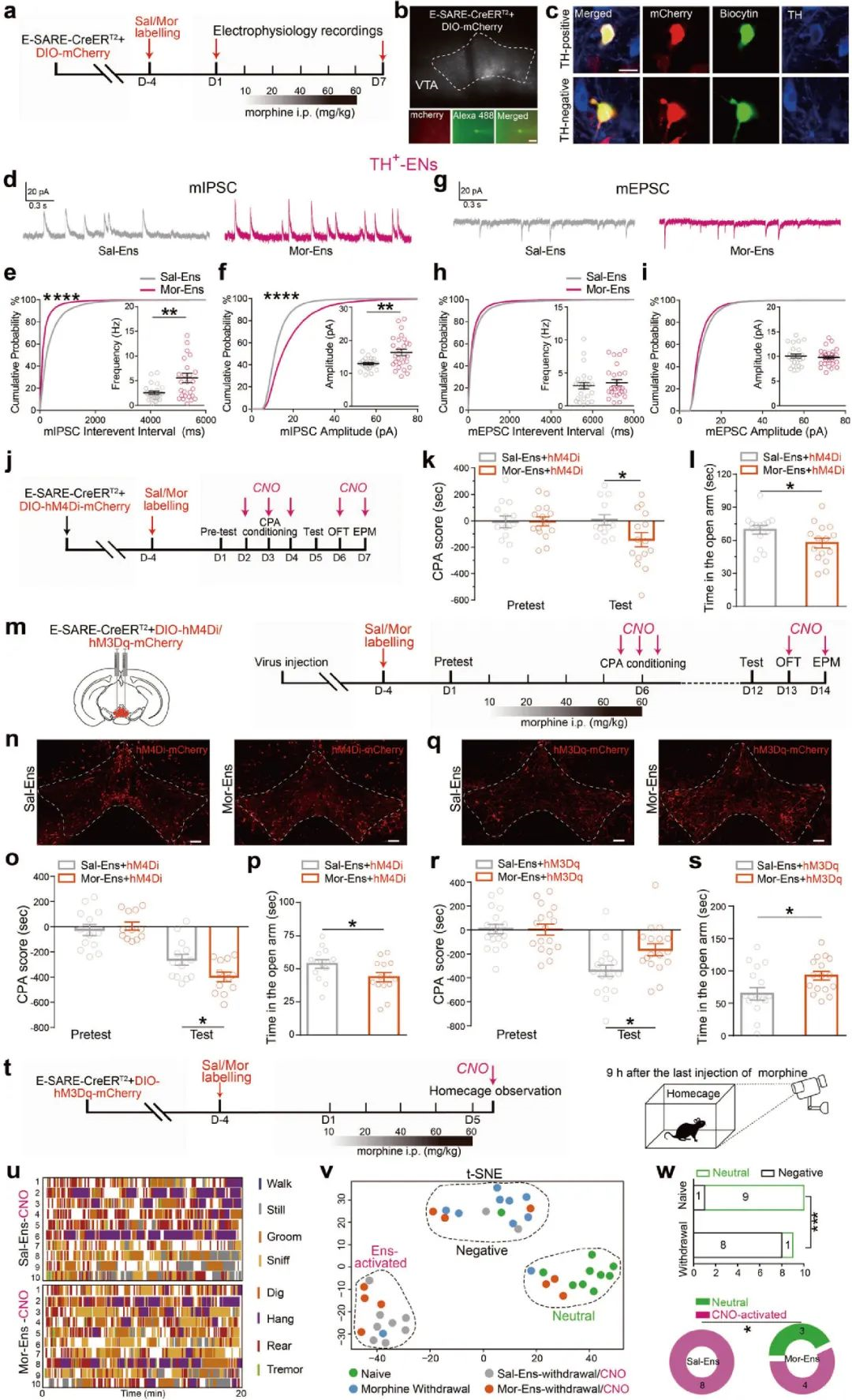
图2 VTA吗啡神经元集群接收的抑制性输入增强,介导戒断诱发的负性强化
3.激活CRHCeA→VTA投射通路可加重吗啡戒断诱发负性情绪
研究发现,促肾上腺皮质激素释放激素(CRH)参与戒断期间相关行为,研究人员在CRH-Cre鼠VTA区注射 AAV-Retro-EF1a-DIO-EYFP,标记在中央杏仁核(central amygdala, CeA)、终纹床核(bed nucleus of stria terminalis, BNST)和下丘脑室旁核(paraventricular nucleus of the hypothalamus, PVN)投射到VTA的CRH神经元。慢性吗啡处理后,CRHCeA→VTA和CRHBNST→VTA神经元中c-Fos表达增加(图3a-c)。
CeA是杏仁体主要的抑制性输出部位,参与情绪加工[4-6]。因此,研究人员借助逆行示踪病毒和电生理技术发现,吗啡慢性给药治疗增加了CRHCeA→VTA神经元mEPSC振幅和频率,提高了神经元兴奋性(图3d-j)。随后,研究人员在CRH-Cre鼠CeA区注射Cre依赖的光遗传学病毒,并在VTA埋入光纤,借助条件性位置厌恶(conditioned place aversion, CPA)、高架十字迷宫(elevated-plus maze, EPM)和旷场实验(open-field, OFT)行为学范式发现,AAV-DIO-eNpHR3.0抑制CRHCeA→VTA投射通路可缓解吗啡戒断诱发的焦虑和厌恶负面情绪(3k-p),AAV-DIO-hChR2激活CRHCeA→VTA投射通路可加重吗啡戒断诱发负性情绪(3q-v)。
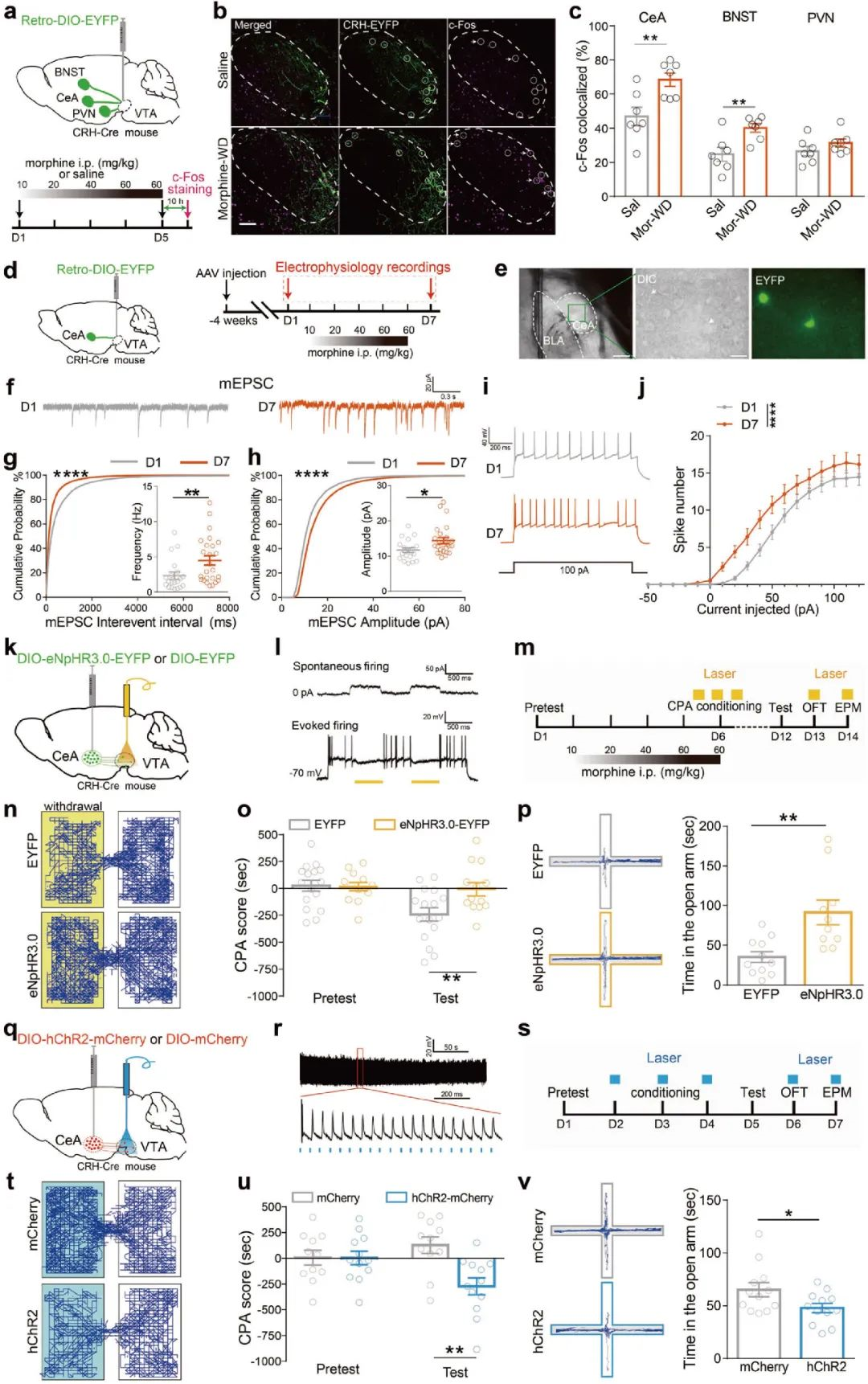
图3 激活CRHCeA→VTA投射通路可加重吗啡戒断诱发负性情绪
4.慢性吗啡给药参与CRHCeA→VTA神经环路重塑
进一步,研究人员在CRH-Cre鼠VTA注射AAV-Retro-EF1a-DIO-EYFP和AAV-Retro-hSyn-tdTomato病毒,c-Fos共标统计发现吗啡慢性给药增加了CeA脑区c-Fos+CRH+神经元的比例(图4a-c),提示了吗啡慢性给药对CRHCeA→VTA神经元活性有特异性调节作用。
为研究CeA到吗啡神经元集群(Mor-Ens)的单突触输入,作者借助E-SARE元件和逆向跨突触病毒系统标记VTA输入神经元,并用荧光探针技术发现CeA crh阳性神经元偏向性地与吗啡神经元集群形成突触连接(图4d-g)。接下来,研究人员在CRH-Cre小鼠CeA注射AAV-DIO-hChR2-mCherry,VTA区注射AAV-RAM-tTA-TRE-EGFP,借助Dox标记体系和光遗传学技术发现,吗啡慢性给药促使CeA中CRH神经元向VTA多巴胺能吗啡神经元集群的抑制性连接增强(图4h-s)。
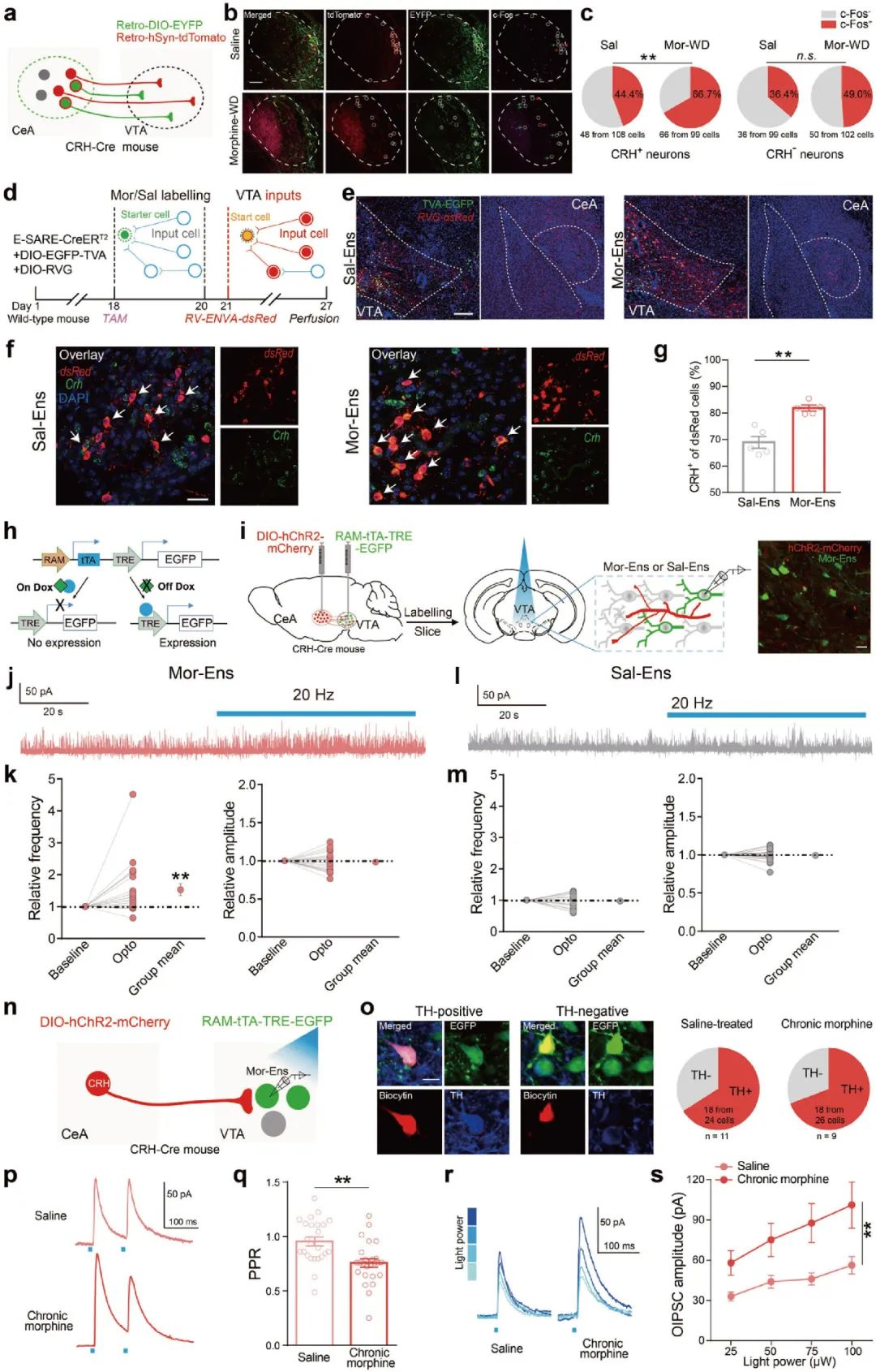
图4 慢性吗啡给药参与CRHCeA→VTA神经环路重塑
5.CRHCeA→VTA通路介导吗啡戒断诱发的厌恶和焦虑等负面情绪的产生
随后,研究人员借助RAM-tTA-TRE/DOX系统做进一步验证,他们在CRH-Cre小鼠VTA注射AAV-RAM-tTA-TRE-hM3Dq病毒,CNO激活VTA吗啡神经元集群导致了小鼠焦虑样行为(图5a-e),这与E-SARE-CreERT2TAM系统得到的结果一致。为观察VTA吗啡神经元集群的激活是否能缓解由CRHCeA→VTA连接增强引起负性情绪,研究人员在CRH-Cre小鼠CeA注射AAV-DIO-hChR2-EYFP,VTA注射AAV-RAM-tTA-TRE-hM3Dq病毒,借助CPA和EPM行为学范式发现,光遗传激活CRHCeA→VTA通路导致的小鼠表现出条件性位置厌恶,同时进入开放臂的次数减少,表现出焦虑样行为,而化学遗传激活VTA吗啡神经元集群则有效改善了这一现象(图5f-j)。
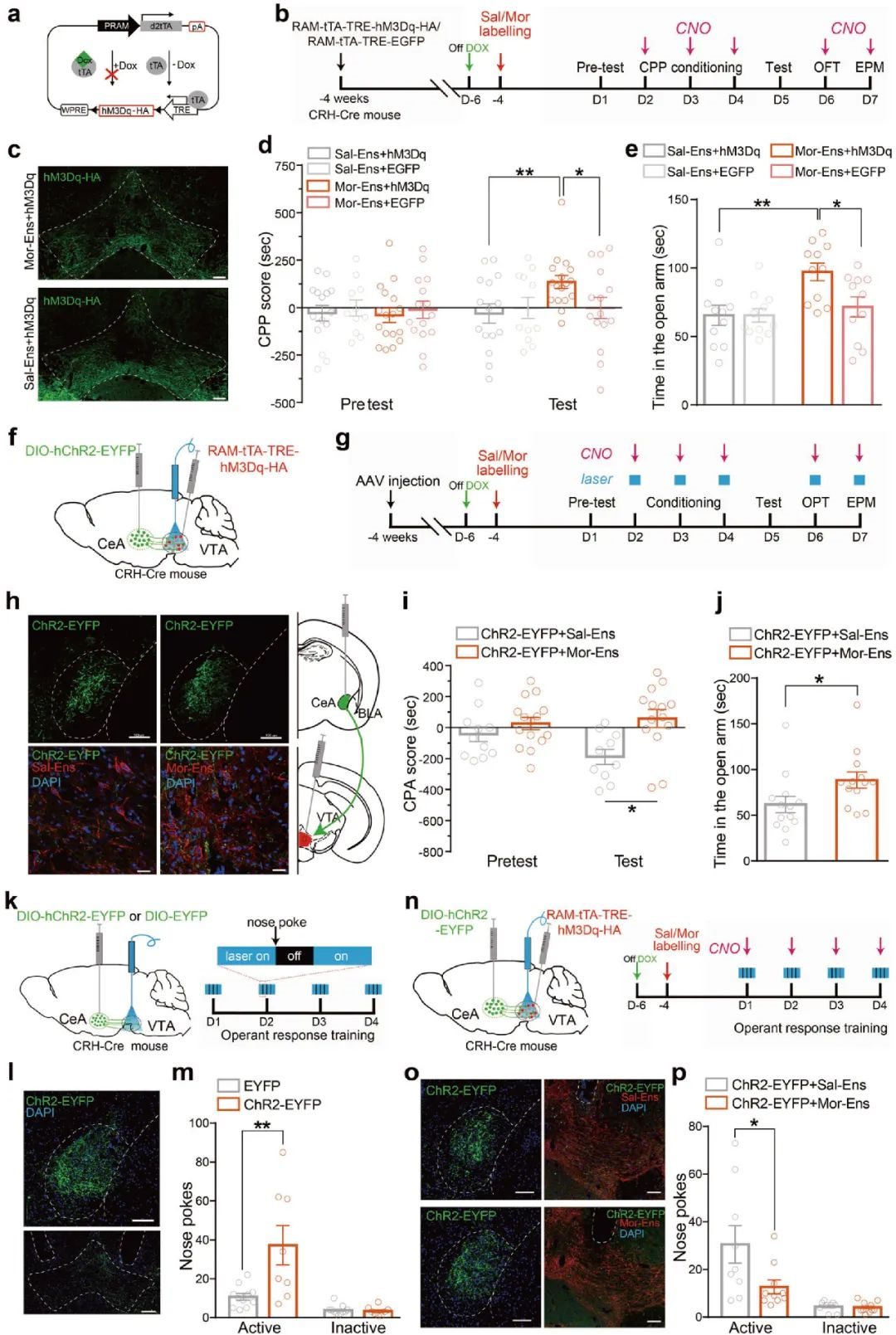
图5 CRHCeA→VTA通路介导吗啡戒断诱发的厌恶和焦虑等负性情绪的产生
6.吗啡神经元集群的CRHR1受体介导CRHCeA→VTA的抑制性输入,参与吗啡戒断诱发的负性情绪
由于光刺激可能触发神经元末梢的神经肽释放[7]。研究人员对CRH受体信号在CeA中CRH神经元向VTA吗啡神经元集群抑制性输入通路的潜在作用做进一步研究。他们在VTA离体脑片做光遗传操作和电生理记录,发现CRHR1受体拮抗剂可显著降低VTA吗啡神经元集群O-IPSCs(optical-evoked inhibitory postsynaptic currents, 光诱发抑制性突触后电流)的振幅和频率,提示了CRHR1受体介导了CRH信号参与吗啡神经元集群的抑制性输入,揭示了CRH信号通路在CeA CRH神经元到VTA吗啡神经元集群投射通路可塑性重塑中的重要作用(图6a-f)。最后,研究人员探究这种神经环路的重塑涉及的具体分子机制,借助CRISPR/Cas9基因编辑技术下调CRHR1的表达,在小鼠VTA区注射AAV-sgCrhr1-mcherry, AAV-RAM-tTA-TRE-Cre和AAV-DIO-saCas9病毒,单分子荧光原位杂交技术(smFISH)发现,VTA吗啡神经元集群中Crhr1 mRNA表达显著下调(图6g-i)。同时,行为学范式结果发现,CRHR1缺失对于小鼠吗啡戒断时期的条件性位置厌恶、自发活动以及糖水偏好行为无明显变化,但是增加了小鼠进入开放臂的次数、悬尾实验(TST)中小鼠挣扎时间以及社交评分,提示了VTA吗啡神经元集群中CRHR1参与吗啡戒断时期包括焦虑、抑郁、社交能力下降等负性情绪的发展(图6j-p)。此外,在CRH-Cre小鼠注射光遗传病毒及RAM/DOX系统介导的CRISPR病毒发现,抑制吗啡神经元集群上的CRHR1受体显著降低O-IPSC振幅,提示了下调CRHR1受体的表达,能显著减弱CeA CRH神经元到VTA吗啡神经元集群的抑制性输入(图6q-s)。综上,CRHR1受体参与CeA CRH神经元到VTA吗啡神经元集群的抑制性输入环路的突触和功能重塑,介导了吗啡戒断诱发的负性强化。
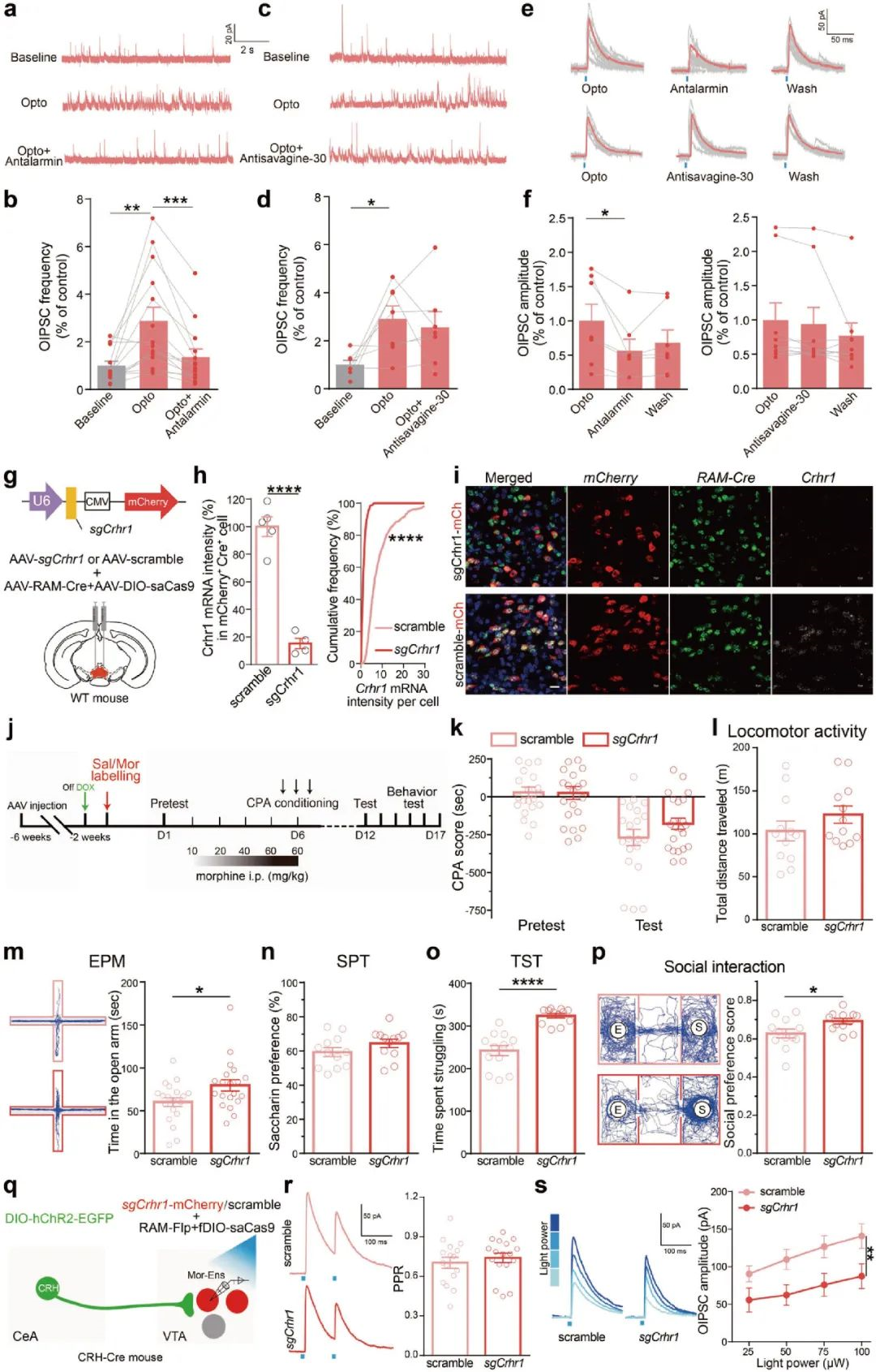
图6 吗啡神经元集群的CRHR1受体介导CRHCeA→VTA的抑制性输入,参与吗啡戒断诱发的负性情绪
本文中,作者首先借助即早基因驱动的标记技术标记了VTA中吗啡初次暴露激活的奖赏神经元集群(吗啡神经元集群),随后,借助病毒载体示踪技术、光遗传学技术、化学遗传学技术、神经递质探针、电生理记录、荧光原位杂交、行为学实验等多种技术手段,发现VTA吗啡神经元集群选择性地投射到NAc,通过多巴胺依赖机制介导正性强化效应,抑制这类神经元集群,会导致戒断诱发的负性强化效应。进一步研究发现,在吗啡慢性给药后,CeA脑区CRH神经元与VTA吗啡神经元集群的抑制性突触连接增强,从而介导了吗啡戒断诱发的厌恶和焦虑等负性情绪的产生。最后,借助CRISPR/Cas9基因编辑技术下调吗啡神经元集群上的CRHR1受体的表达可减弱CRHCeA→VTA的抑制性输入,缓解吗啡戒断诱发的负面情绪。该研究阐明了成瘾性药物吗啡负性强化环路和分子机制,为治疗成瘾、防止药物滥用提供新的干预靶点,具有重要科学和社会意义。复旦大学脑科学研究院博士后江长优为本文的第一作者,基础医学院博士研究生杨霄和何观虹为本文的共同第一作者。脑科学研究院的马兰教授与王菲菲教授为本文的通讯作者。本文的合作者还有来自复旦大学附属华山医院的毛颖教授和徐文东教授。







